《细胞》:科学家发现全新的细胞死亡方式!有望带来癌症治疗新策略
来源:学术经纬 2025-12-02 14:34
当线粒体持续存在于细胞膜附近时,会持续造成局部氧化损伤,最终导致细胞自行溶解和死亡。研究发现,这一过程受特定炎症和代谢信号通路调控,并且该死亡类型可以在癌症中被主动激活,从而抑制肿瘤生长。
在我们的身体里,细胞无时无刻不在进行着生死抉择。面对感染、炎症或营养匮乏,细胞有时会主动选择死亡,以牺牲个体来保全整体——这个过程被称为“程序性细胞死亡”。长久以来,科学家们已经发现了多种细胞死亡方式,例如导致细胞“温和”分解的细胞凋亡(Apoptosis),以及引发剧烈炎症反应的细胞焦亡(Pyroptosis)、坏死性凋亡(Necroptosis) 等。
而最近《细胞》杂志一项研究又揭示了一种前所未见的细胞死亡新形式——Mitoxoperilysis,代表着线粒体氧化导致的细胞溶解。具体来看,当线粒体持续存在于细胞膜附近时,会持续造成局部氧化损伤,最终导致细胞自行溶解和死亡。研究发现,这一过程受特定炎症和代谢信号通路调控,并且该死亡类型可以在癌症中被主动激活,从而抑制肿瘤生长。

在感染或肿瘤等病理状态下,我们的身体常常会同时面临两大挑战:一方面是免疫系统被激活,释放大量炎症信号;另一方面是组织局部营养供给不足,细胞处于“饥饿”状态。
有趣的是,实验显示单独的能量剥夺(如去除葡萄糖)或单独的免疫刺激,都不足以杀死作为免疫哨兵的巨噬细胞。但当两种条件同时存在时,巨噬细胞就会迅速走向一种剧烈、溶解性的死亡。在动物实验中,预先禁食的小鼠在遭受细菌毒素攻击后,死亡率也显著高于正常进食的小鼠,并伴有更严重的组织损伤。
这表明,免疫危机与代谢危机“双管齐下”,触发了一种独特的、强大的细胞死亡程序。
▲研究示意图(图片来源:参考资料[1])
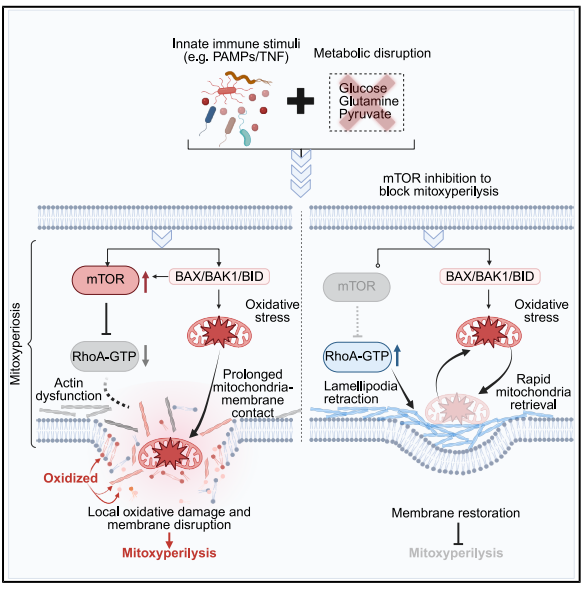
为了找到答案,研究团队进行了一系列严密的排查。他们首先排除了已知的程序性死亡相关的蛋白,确定该过程与细胞凋亡、焦亡或铁死亡无关。随后,代谢组学分析显示,在这种死亡模式下,细胞内的抗氧化分子——谷胱甘肽(GSH)水平会急剧下降,导致细胞处于严重的氧化应激状态。
除此之外,细胞的活性氧水平也异常的高。进一步的追踪分析表明,这些活性氧的主要来源是细胞的能量工厂“线粒体”。借助活细胞成像技术,研究者发现正常情况下,线粒体在细胞内动态移动,与细胞膜只是短暂接触。但在“免疫+饥饿”的刺激下,处于氧化应激状态的线粒体会长时间、稳定地紧贴在细胞膜内侧。
尽管活性氧寿命极短,但距离其产生源“线粒体”越近,破坏力越强。随着局部的脂质氧化损伤不断累积,最终导致细胞膜在该点破裂,细胞内容物泄漏,细胞迅速崩解死亡。
这一发现也为癌症治疗带来了全新启示,因为肿瘤微环境恰恰兼具了慢性炎症和营养竞争两大特征。研究者尝试让黑色素瘤小鼠执行了短期禁食以模拟代谢压力,并向肿瘤注射了细菌毒素以模拟局部免疫激活。这一举措严重干扰了肿瘤的生长,肿瘤体积显著缩小,并出现大面积坏死。
这提示,模拟禁食饮食等饮食干预与局部免疫刺激相结合,或能通过激活肿瘤细胞自身的Mitoxoperilysis通路“杀死”肿瘤,为癌症治疗提供一种新策略。
参考资料:
[1] Innate immune and metabolic signals induce mitochondria-dependent membrane lysis via mitoxyperiosis. Cell (2025). DOI: 10.1016/j.cell.2025.11.002
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


